2019年广东省深圳市中考化学试卷
一、选择题(共10小题,每小题1.5分,共15分.在每小题给出的4个选项中,只有一项符合题意.)
1.(1.5分)化学与人类的生产、生活密切相关。下列描述正确的是( )
A.引起贫血的主要原因是缺锌B.不合理施用化肥会造成水体污染
C. 是电池回收标志D.用水喷淋燃着的酒精以降低着火点
是电池回收标志D.用水喷淋燃着的酒精以降低着火点
2.(1.5分)下列化学用语表述正确的是( )
A.硫酸钾的化学式:K2SO4B.1个氯分子:Cl
C.2个硝酸根:2NO2D.铜离子:![]()
3.(1.5分)下列实验不涉及化学变化的是( )
|
|
|
|
测定空气中O2的含量 | 验证浓H2SO4的腐蚀性 | 比较合金与纯金属的硬度 | 判断溶液的酸碱性 |
A.AB.BC.CD.D

4.(1.5分)钪(Kc)是一种“工业的维生素”。图为钪在元素周期表中的相关信息及其原子的结构示意图。下列说法正确的是( )
A.钪属于非金属元素
B.钪的相对原子质量是21
C.原子结构示意图中x=10
D.钪原子核外有四个电子层

5.(1.5分)科学家研制出一种新型催化剂,可用于去除装修残留的甲醛(化学式为CH2O),该反应过程的微观示意图如图。下列说法正确的是( )
A.物质甲为甲醛,其分子由碳原子和水分子构成B.物质乙中氧元素的化合价为﹣2价
C.该反应前后原子种类和数目均发生改变D.该反应消耗物质甲和生成物质丁的质量比为5:3
6.(1.5分)CuO粉末与H2在加热条件下会发生反应。下列说法错误的是( )
A.反应所需H2可由Cu与稀H2SO4反应制得B.反应过程可观察到固体粉末由黑色变成红色
C.发生的反应为CuO+H2![]() Cu+H2OD.该反应说明H2具有还原性
Cu+H2OD.该反应说明H2具有还原性
7.(1.5分)异烟肼(化学式:C6H7N3O;相对分子质量:137)是治疗肺结核药物的有效成分。下列说法正确的是( )
A.异烟肼属于氧化物B.异烟肼分子中H、O原子个数比为7:1
C.异烟肼中C、H两种元素的质量比为36:7
D.异烟肼中N元素质量分数的计算式为![]() ×100%
×100%
8.(1.5分)为达到以下实验目的,下列相应实验方案合理的是( )
选项 | 实验目的 | 实验方案 |
A | 获得廉价的新能源 | 电解水制H2 |
B | 将河水净化为纯水 | 经沉淀、过滤、吸附 |
C | 验证金属活动性Zn>Cu | 利用Zn片与CuSO4溶液的反应 |
D | 除去NaCl固体中少量的MgCl2 | 加水溶解,再加入过量NaOH溶液 |
A.AB.BC.CD.D
 9.(1.5分)现有t2℃时的溶液Ⅰ、Ⅱ各100g,溶液I中含物质甲50g,
9.(1.5分)现有t2℃时的溶液Ⅰ、Ⅱ各100g,溶液I中含物质甲50g,
溶液Ⅱ是物质乙的饱和溶液。物质甲、乙(均不含结晶水)的溶解度
曲线如图所示。下列说法正确的是( )
A.t2℃时,溶液Ⅰ是甲的饱和溶液
B.t2℃时,溶液Ⅰ中甲的质量分数为50%
C.t2℃时,溶液Ⅱ中含乙37g
D.从t2℃降温至t1℃时,乙不会从溶液Ⅱ中析出
 10.(1.5分)关系图中“﹣”两端的物质能发生化学反应,“→”表示物质的转化方向。下列说法错误的是( )
10.(1.5分)关系图中“﹣”两端的物质能发生化学反应,“→”表示物质的转化方向。下列说法错误的是( )
A.反应①放出热量
B.反应②所得溶液可呈中性
C.反应③可得NaOH
D.不能将图中稀盐酸换为稀H2SO4
二、非选择题(共3题,共25分)
11.(8分)生铁用途十分广泛。工业上利用赤铁矿(主要成分是Fe2O3,还含少量SiO2等杂质)冶炼生铁的过程如图:

回答下列问题:
(1)生铁属于材料(填“合成”或“金属”)。“高炉气体”中的(填化学式)会导致酸雨。
(2)“煅烧”时:
①生成CO的反应之一为C+CO2![]() 2CO,该反应属于反应(填基本反应类型)。
2CO,该反应属于反应(填基本反应类型)。
②用化学方程式表示利用CO炼铁的原理。
③CaCO3和SiO2固体在高温条件下发生反应,生成CO2气体和CaSiO3,该反应的化学方程式为。
(3)生活中铁制品锈蚀的过程,实际上是Fe与空气中、等发生化学反应的过程。下列措施能防止铁制品锈蚀的是(填标号)。
A.涂油、喷漆B.镀耐腐蚀的铬层C.用盐水清洗D.久置于酸性环境
12.(8分)为探究某塑料的组成元素,设计了实验I和II.回答下列问题:
I.制取氧气
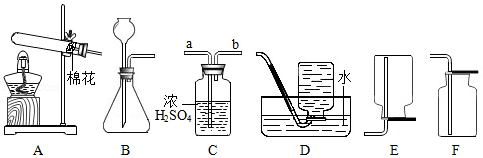
(1)若用一种暗紫色固体制取O2,发生反应的化学方程式为,发生装置应选择上述装置(填标号)。
(2)欲制取干燥的O2,装置合理的连接顺序为:发生装置→C→(填标号)。连接装置时,发生装置的出气口应与装置C中(填“a”或“b”)端相连。
II.组成探究
(3)定性检测(已知:无水CuSO4遇水变蓝色)

实验操作 | 实验现象 | 结论 |
连接装置,检查气密性,装入试 剂并按如图进行实验。通入O2, 一段时间后,点燃J处酒精灯。 | 装置K中无水CuSO4变 ①色 | 塑料燃烧产物中有H2O |
装置L中②。 | 塑料燃烧产物中有CO2 |
③由上述实验可知,该塑料一定含有的元素是(填元素符号)。
(4)定量测定
为进一步确定组成,将1.4g该塑料在足量O2中完全燃烧,共产生了4.4g CO2和1.8g H2O,依据质量守恒定律,可判断该塑料(填“含有”或“不含”)除上述③中结论之外的元素。
13.(9分)已知:①NaHCO3固体受热分解2NaHCO3![]() Na2CO3+CO2↑+H2O;②Na2CO3受热不分解。回答下列问题:
Na2CO3+CO2↑+H2O;②Na2CO3受热不分解。回答下列问题:
(1)关于NaHCO3固体的叙述错误的是(填标号)。欲测定某NaHCO3固体样品(只含Na2CO3杂质且分布均匀)中NaHCO3的质量分数,将5.0g该样品加热至质量不再改变,测得剩余固体的质量、生成CO2的质量随时间变化如图所示。
A.俗称小苏打B.难溶于水
C.可与稀盐酸发生反应D.是发酵粉的主要成分之一
(2)欲测定某NaHCO3固体样品(只含Na2CO3杂质且分布均匀)中NaHCO3的质量分数,将5.0g该样品加热至质量不再改变,测得剩余固体的质量、生成CO2的质量随时间变化如图所示。
①NaOH溶液的pH7(填“>”、“=”或“<”),用该溶液将生成的CO2完全吸收,发生反应的化学方程式为。
②由图中数据可知,上述5.0g NaHCO3样品完全分解产生CO2的质量为g,产生H2O的质量是g。
③计算该样品中NaHCO3的质量分数(根据化学方程式写出完整的计算步骤)。