2019年广东省广州市中考化学试卷
一、选择题(本题包括20小题,每小题2分,共40分)注意:每道选择题有四个选项,其中只有一项符合愿意.请用铅笔在答题卡上作答.选错、不选、多选或涂改不清的,均不给分.
1.(2分)做好垃圾分类,为绿色发展做贡献。下列可回收垃圾主要成分为有机合成材料的是( )
A.旧报纸B.塑料瓶C.铝制易拉罐D.玻璃瓶
2.(2分)“食在广州”,下列广州美食中富含蛋白质的是( )
A.增城迟菜心B.从化荔枝C.沙湾姜撞奶D.沙河粉
3.(2分)空气是一种宝贵的资源,下列生产生活中用到的气体不是来自空气的是( )
A.作为燃料电池燃料的H2B.用于生产氮肥的N2
C.用于医疗急救的O2D.用于飞艇的He
4.(2分)下列过程中,发生了化学变化的是( )
A.干冰变成CO2气体
B.从含SiO2的沙子中提炼高纯Si
C.海水晒盐
D.从潮湿空气中分离出水
5.(2分)下列实验操正确的是( )
A. 将蒸发皿直接加热
将蒸发皿直接加热
B. 取液后的胶头滴管平放在桌面上
取液后的胶头滴管平放在桌面上
C. 用燃着的酒精灯点燃酒精灯
用燃着的酒精灯点燃酒精灯
D.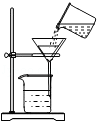 将混合液倒入过滤器过滤
将混合液倒入过滤器过滤
6.(2分)如图为某反应的微观示意图,“![]() ”、“
”、“![]() ”各表示一种原子,下列说法不正确的是( )
”各表示一种原子,下列说法不正确的是( )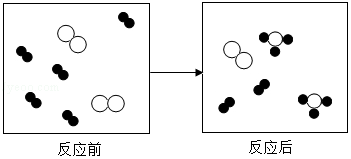
A.反应物是两种单质B.反应物有剩余
C.该反应为化合反应D.该反应生成了多种产物
7.(2分)下列物质的使用能够达到目的是( )
A.用明矾对水进行杀菌消毒
B.用碱液清洗水垢
C.用生石灰和水作为“自热米饭”的热源
D.用活性炭将硬水软化
8.(2分)超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气:2KO2+2H2O═2KOH+X+O2↑,关于此反应的说法不正确的是( )
A.X的化学式为H2O2
B.反应前后元素种类发生变化
C.反应前后氧元素化合价发生变化
D.反应前后物质状态发生变化
9.(2分)下列物质的性质与用途均正确并相对应的是( )
| 性质 | 用途 |
A | 铝在空气中与氧气反应生成致密氧化膜 | 铝合金用于制作卫生间的置物架 |
B | 钨的导电性好 | 钨用于制作灯泡里的灯丝 |
C | CO2水溶液显酸性 | CO2用作大棚蔬菜的气体肥料 |
D | 氢氧化钠能够与酸反应 | 氢氧化钠用于改良酸性土壤 |
A.AB.BC.CD.D
10.(2分)下列关于氯化钠的认识,正确的是( )
A.组成:含有钠和氯两种单质
B.性质:与盐酸类似,能与碳酸盐反应
C.用途:可用于生产金属钠
D.生产:常用钠与氯气通过化合反应获得
11.(2分)中国古代诗句中蕴含有很多化学原理,下列诗句的解释不正确的是( )
| 诗句 | 解释 |
A | 吴山开,越溪涸,三金合冶成宝锷 | “宝锷”的成分为合金 |
B | 遥知不是雪,为有暗香来 | 分子在不停地运动 |
C | 千淘万漉虽辛苦,吹尽狂沙始到金 | 金的密度比沙大 |
D | 千锤万凿出深山,烈火焚烧若等闲 | 煅烧生石灰得到熟石灰 |
A.AB.BC.CD.D
12.(2分)燃料和能源与生活息息相关,下列说法正确的是( )
A.石油是一种清洁能源,也是一种可再生能源
B.炒菜时油锅着火,应立即用水浇灭
C.“钻木取火”的原理是通过摩擦生热提高木材的着火点
D.燃气灶火焰出现黄色,锅底出现黑色时,可增大灶具进风口
13.(2分)25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( )
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A.实验①所得溶液质量分数为10%
B.实验②说明25℃时该物质的溶解度是20g
C.实验③④所得溶液质量分数相同
D.实验④所得溶液中含溶质20g
14.(2分)从地沟油中提炼生物柴油是垃圾资源化的方法之一。生物柴油主要成分是硬脂酸甲酯(C19H38O2),下列有关硬脂酸甲酯的说法正确的是( )
A.C、H、O三种元素的质量比为19:38:2
B.相对分子质量为(12×19+1×38+16×2)
C.C、H、O三种原子的个数比为12:1:16
D.氧元素的质量分数为![]() ×100%
×100%
15.(2分)煤和燃油的燃烧是造成空气污染的重要原因,下列排放物能形成酸雨的是( )
A.SO2、NO2B.CO、CO2
C.烟尘D.未充分燃烧的汽油
16.(2分)下列物质混合后能够反应,且有明显现象的是( )
A.向氧化铁粉末中滴入氢氧化钠溶液
B.向稀硫酸中滴入稀氢氧化钾溶液
C.将硫酸铵与熟石灰混合研磨
D.向澄清石灰水中滴入氯化钡溶液
17.(2分)某微粒M的结构示意图如图,关于该微粒的说法正确的是( )

A.M的原子易失电子B.x只能为7
C.M为金属元素D.x为8时,M为阴离子
18.(2分)下列物质与空气充分混合后,遇明火不会发生爆炸的是( )
A.P2O5B.面粉C.镁粉D.CH4
19.(2分)除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是( )
A.Zn粉(Fe):用ZnCl2溶液浸泡,过滤
B.碳粉(MnO2):滴入H2O2溶液,过滤
C.NaCl溶液(Na2SO4):加入适量MgCl2溶液,过滤
D.CO2(H2O):通过盛有浓硫酸的洗气瓶
20.(2分)下列实验中,现象正确且可得到相应结论的是( )
| 实验操作 | 现象 | 结论 |
A | 把硫在空气中点燃,再伸进充满氧气的集气瓶里 | 硫在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰 | 硫在空气中燃烧生成SO2,在氧气中燃烧生成SO3 |
B | 在电解器的玻璃管中加满水,接通直流电源 | 两极玻璃管中有气体生成,体积比是1:2 | 水是化合物,可分解 |
C | 高温条件下,将CO通入Fe2O3粉末 | 黑色粉末变为红色 | 可利用CO的还原性来炼铁 |
D | 将带火星的木条置于一瓶盛有氧气的集气瓶口上方 | 木条不复燃 | O2能支持燃烧 |
A.AB.BC.CD.D
二、(本题包括5小题,共30分)
21.(3分)地球大气中存在氧气(O2)和臭氧(O3)两种含氧元素的单质,其中臭氧氧主要存在于15000﹣30000米的高空,能减弱高能量紫外线对地球表面的辐射。
(1)O3表示一个(填“原子”、“分子”或“离子”)
(2)高空中可发生转化:2O3![]() 3O2,该变化属于(填“物理”或“化学”)变化。
3O2,该变化属于(填“物理”或“化学”)变化。
(3)镁在氧气中燃烧的化学方程式是。
22.(5分)氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。
(1)在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是。
(2)向盛有NaHCO3粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是,发生反应的化学方程式是。
(3)画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注(水分子不用画出)。

23.(5分)有一包白色固体样品,可能含有NaOH、Na2CO3、K2SO4、BaCl2中的一种或几种,为确定其组成,进行如下实验:
步骤Ⅰ:取少量样品于烧杯中,加足量水,充分搅拌,静置,有固体剩余。
步骤Ⅱ:取步骤I所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色;再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液。
步骤Ⅲ:取步骤Ⅱ所得溶液于试管中,滴入过量Ba(NO3)2溶液,无明显现象。
根据上述实验,回答下列问题:
(1)步骤Ⅱ中溶液的红色褪去,发生反应的化学方程式是。
(2)分析上述实验过程,关于样品的组成,可以得到的结论是。
(3)若要进一步确定样品的组成,还需进行的实验操作是。
24.(7分)2019年是国际元素周期表年。俄国化学家门捷列夫在公布元素周期表时,就预言了当时还未发现的相对原子质最约为68的元素的存在,且性质与铝相似,称为“类铝”。如图是元素周期表中“类铝”元素镓的相关信息,请同答下列问题:
(1)镓原子核外电子数为。
(2)金属镓与稀硫酸反应,产物中Ga的化合价为+3,反应的化学方程式是。
(3)高纯氧化镓广泛用于生产半导体材料,其一种制备方法如下:
步骤Ⅰ:向含有硫酸的硫酸镓溶液中通入氨气(NH3),冷却,生成Ga(NH4)(SO4)2固体。
步骤Ⅱ:在一定条件下灼烧Ga(NH4)(SO4)2固体,制得高纯氧化镓。
①Ga(NH4)(SO4)2中含有的带电的原子团(根)是(填化学符号)。
②步骤Ⅰ反应的化学方程式是。

25.(10分)稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的一种工艺如图: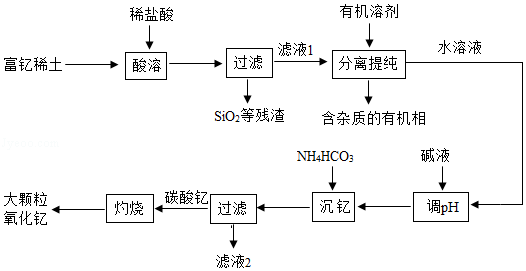
(1)氧化钇(Y2O3)中,Y元素的化合价为。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是。
(3)“分离提纯”是为了除去滤液1中的(填化学式)。
(4)“调pH”时加入碱液使溶液的pH(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是。
(6)为了获得大颗粒氧化钇,某小组研究了条件对产品直径的影响,相关数据如下(D50表示颗粒直径):
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
沉淀反应温度/℃ | 60 | 80 | 85 | 93 | 93 | 93 |
料液浓度/(g/L) | 30 | 30 | 30 | 30 | 40 | 40 |
灼烧温度/℃ | 1100 | 1100 | 1100 | 1100 | 1100 | 1400 |
氧化钇D50/um | 6.00 | 21.65 | 35.99 | 38.56 | 35.99 | 61.54 |
分析上表数据,其他条件不变时,若将灼烧温度均升高至1400℃,预期所得氧化钇D50最大的是(填实验编号)。
三、(本题包括4小题,共30分)
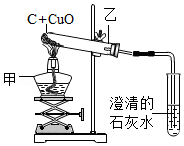
26.(4分)实验室有如图所示装置,回答下列问题:
(1)连接装置时,需根据导管的高度调节处的高度,再确定处的高度。(填“甲”或“乙”)
(2)结束实验的操作是:先,再。
27.(7分)如图1是实验室制取CO2及进行性质实验的部分装置。

(1)CaCO3固体与稀盐酸反应生成CO2气体的化学方程式是。
(2)检验装置气密性,按图连接装置,先,再加水至A下端形成一段水柱,静置,若观察到,说明气密性良好。
(3)加入药品。添加块状CaCO3固体时,为避免打破锥形瓶,应将锥形瓶,再放入固体。添加盐酸时,将稀盐酸从(填仪器A的名称)倒入锥形瓶至。
(4)如图2所示,向放置有燃着的蜡烛的烧杯中倒入CO2,观察到的现象是。
28.(9分)实验室配制饱和澄清石灰水和质量分数为10%的氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
物质 | Ca(OH)2 | NaOH | CaCO3 | Ca(HCO3)2 | Na2CO3 | NaHCO3 |
溶解度/g | 0.16 | 109 | 0.0065 | 16.6 | 21.8 | 9.6 |
(1)配制溶液。其中配制100g 10%氢氧化钠溶液的基本步骤是:
称取氢氧化钠固体﹣量取水﹣溶解﹣装瓶﹣贴标签。
①称取氢氧化钠固体的质量g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,画出水的液面。
③装瓶后贴标签,在标签上填写:。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为g,或需10%氢氧化钠溶液的质量至少为g.(计算结果精确到个位)
![]()
29.(10分)已知金属钴(Co)的活动性与铁相似,请预测氯化钴(CoCl2)的化学性质,说明预测的依据,并设计实验验证。经查阅资料,钴的化合物相关性质如下:
物质 | CoO | Co(OH)2 | CoCl2 | CoSO4 | Co(NO3)2 | CoCO3 |
在水中的溶解性 | 难溶于水的灰绿色固体 | 难溶于水的粉红色固体 | 易溶于水形成粉红色溶液 | 易溶于水形成粉红色溶液 | 易溶于水形成粉红色溶液 | 难溶于水的粉红色固体 |
限选试剂:CoCl2溶液、(NH4)2CO3溶液、Na2SO4溶液、AgNO3溶液、NaOH溶液、稀硫酸、镁条、铜片。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
①能够与含Ag+的 可溶性盐反应 | CoCl2溶液中含Cl﹣, AgCl难溶于水。 | 取少量CoCl2溶液于试管中,,如果观察到,则预测成立。 |
②能够与 (填物质类别)反应 | 取少量CoCl2溶液于试管中,,如果观察到,则预测成立。 | |
③能够与 (填物质类别)反应 | 取少量CoCl2溶液于试管中,,如果观察到,则预测成立。 |






